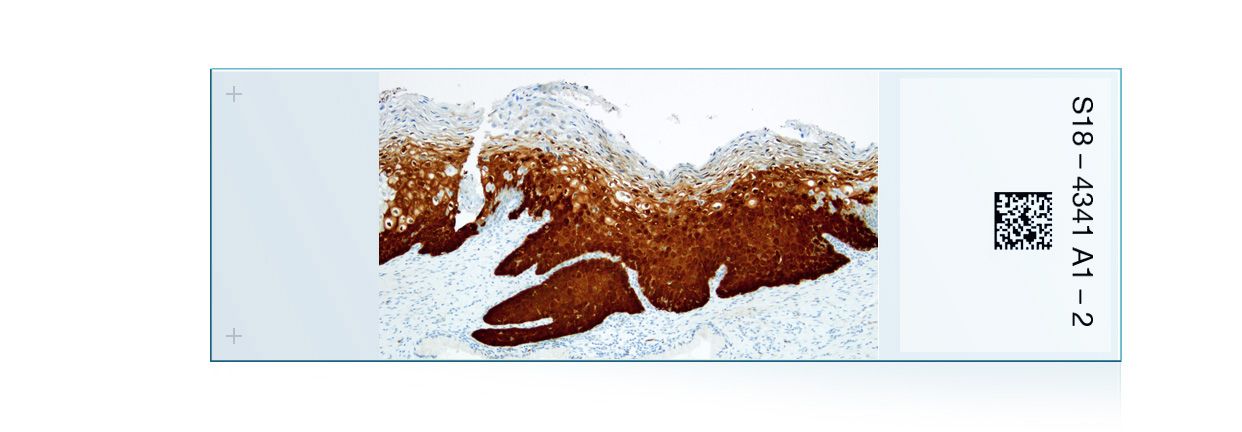
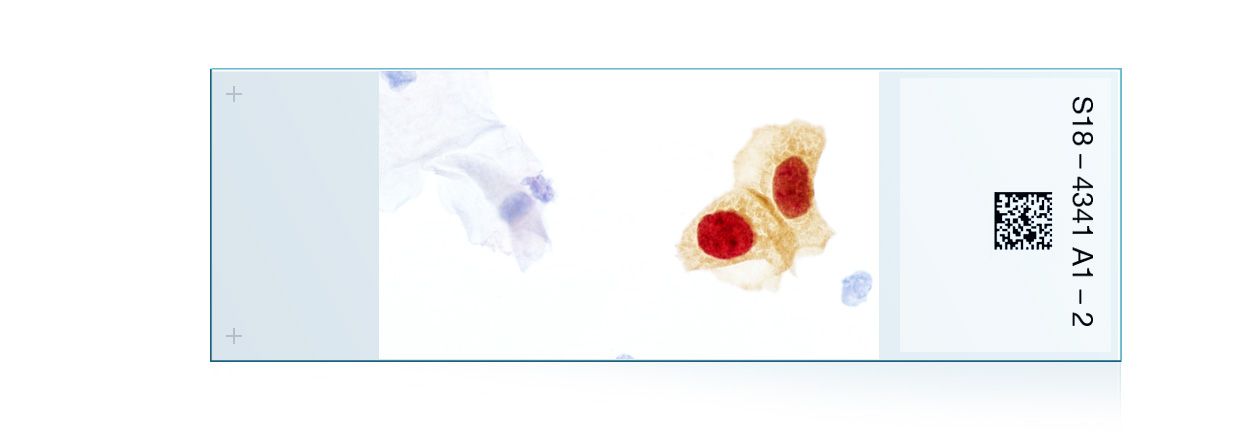
的cobas®4800人乳头状瘤病毒(HPV)试验是一种体外定性检测患者标本中人乳头状瘤病毒的试验。该检测利用聚合酶链式反应(PCR)和核酸杂交扩增目标DNA,在一次分析中检测14种高危(HR) HPV类型。该测试专门识别HPV16和HPV18(类型),同时在临床相关感染水平上检测其他高危类型(31、33、35、39、45、51、52、56、58、59、66和68)。标本仅限于在罗氏细胞收集培养基(罗氏分子系统公司)中收集的宫颈细胞,cobas®PCR细胞收集培养基(罗氏分子系统公司),PreservCyt®solutions (Cytyc Corp.)和SurePath™防腐剂液(BD诊断- tripath)。
使用适应症cobas®4800人乳头瘤病毒测试包括:
(一)cobas®4800 HPV检测适用于筛查21岁及以上有ASC-US(非典型鳞状细胞,意义不明)宫颈细胞学结果的患者,以确定是否需要转介至阴道镜检查。
(b)cobas®4800 HPV试验适用于筛查21岁及以上具有ASC-US宫颈细胞学结果的患者,以评估高危HPV基因型16和18的存在与否。
(c)cobas®4800 HPV检测适用于30岁及以上的患者,辅助宫颈细胞学检查以评估是否存在高危HPV类型。
(d)cobas®4800 HPV检测适用于30岁及以上的患者,辅助宫颈细胞学检查,以评估HPV基因型16和18的存在与否。
(e)cobas®4800人乳头瘤病毒试验适用于25岁及以上患者的一线初级筛查试验,以确定宫颈癌发展风险增加或存在高级别疾病的妇女。
(f)cobas®4800 HPV试验用于25岁及以上患者的一线初级筛查试验,以评估HPV基因型16和18的存在与否。
(g)的结果cobas®4800 HPV检测,连同医生对细胞学史、其他危险因素和专业指南的评估,可用于指导患者管理。研究的结果cobas®HPV检测并不会阻止女性进行阴道镜检查。