明确结果。自信的决定。
这雪斯®EGFR突变试验V2是实时聚合酶链反应(PCR)试验,其鉴定表皮生长因子受体(EGFR)基因的外显子18,19,20和21中的42个突变,包括T790M电阻突变。1
这雪斯®EGFR突变试验V2已在多种临床试验中临床验证,作为第1和第2线EGFR TKI治疗的伴随诊断(CDX),患有先进的非小细胞肺癌[NSCLC)。2卓越的鲁棒性和可重复性雪斯®EGFR突变试验V2已在现实世界和实验室内研究中证明,3.对使用测试的实验室提供高度信心。
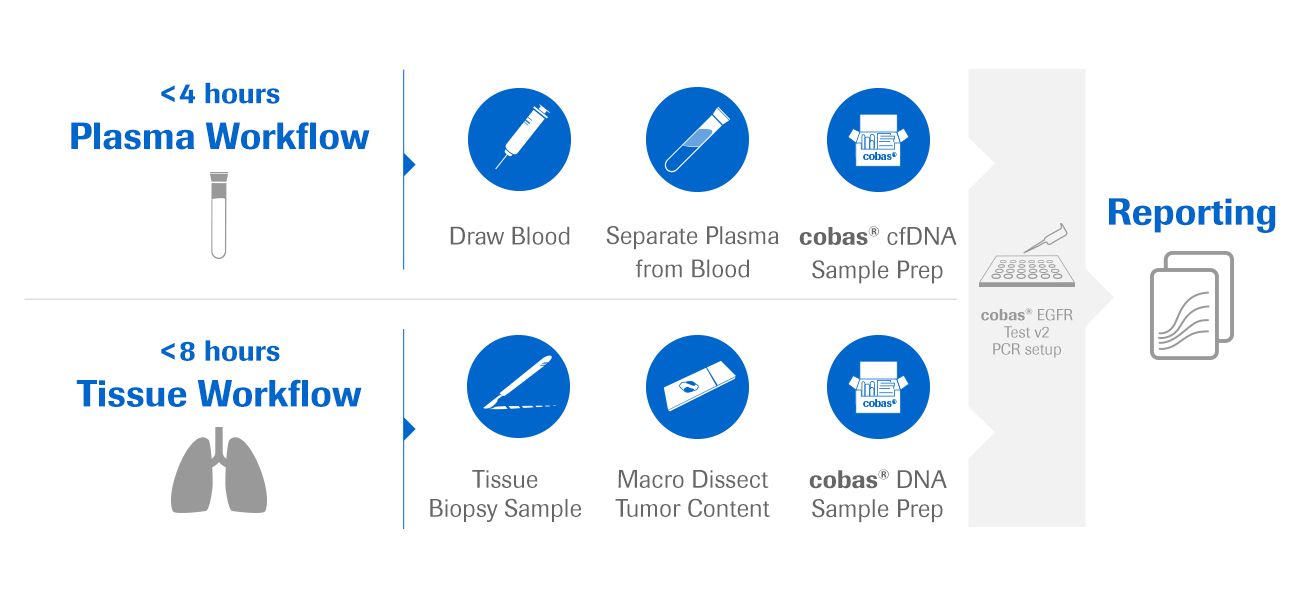
它旨在与单个试剂盒同时进行快速的时间效果测试两种组织和血浆样本(组织结果<8小时,血浆结果<4小时)。
对于优化的工作流程结果,Roche开发了雪斯®用于从福尔马林固定的石蜡包埋的组织(FFPET)的DNA提取的DNA样品制剂试剂盒雪斯®用于从血浆中提取DNA的CFDNA样品制剂试剂盒。